重金属研究NMT标准化方案
重金属研究NMT标准化方案
一、视频资源
二、参考文献
C2019-023,熊杰,浙江理工大学,Rice,水稻,根(距离根尖200μm,500μm),O2、Cd2+
Aeration Increases Cadmium (Cd) Retention by Enhancing Iron Plaque Formation and Regulating Pectin Synthesis in the Roots of Rice (Oryza sativa) Seedlings
C2019-024,柴团耀,中国科学院大学生命科学学院,BMC Plant Biol ,酵母菌、大肠杆菌,酵母细胞,大肠杆菌细胞,Cd2+
C2019-032,张振华,湖南农业大学,plant sci,Cd2+、NO3-
C2018-030,廉菲,江南大学,Sci Total Environ,水稻,根冠、伸长区、根毛区,Cd2+
C2018-047,周功克,中科院青岛生物能源与过程研究所,Chemosphere,浮萍,根(根尖、距离根尖400μm,1000μm)
叶(顶点、节点、顶点与节点中间的位置),Cd2+
C2018-052,李银心,中科院植物研究所,Plant Biotechnol J,甜高粱,根部(距离根尖300μm),Cd2+
C2018-059,李廷强,浙江大学,Plant Cell Environ,东南景天,根部距离根尖2.5mm至3mm,Cd2+
C2019-001,潘科,深圳大学,Chemosphere,硅藻,藻细胞,Cd2+
C2019-013,张伟、高建伟,山东大学、山东省农科院,Plant Physiology,拟南芥,根(距离根尖400μm),Cd2+
C2019-034,王果,福建农林大学,Chemosphere,Cd2+
Chlorine weaken the immobilization of Cd in soil-rice systems by biochar
C2017-034,李芳柏,广东省科学院生态环境研究所,Environmental Pollution,悬浮细胞,Cd2+
Silica nanoparticles alleviate cadmium toxicity in rice cells: Mechanisms and size effects
C2015-003,王荔军,华中农业大学,New Phytologist,悬浮细胞,Cd2+
A hemicellulose-bound form of silicon inhibits cadmium ion uptake in rice (Oryza sativa) cells
C2015-001,罗志斌,西北农林科技大学,New Phytologist,根,Ca2+/Cd2+/H+
C2013-019,王荔军,华中农业大学,New Phytologist,悬浮细胞,Cd2+
Inhibition of cadmium ion uptake in rice (Oryza sativa) cells by a wall-bound form of silicon
C2013-015,罗志斌,西北农林科技大学,PLANT CELL ENVIRON ,根,Cd2+H+
Ectomycorrhizas with Paxillus involutus enhance cadmium uptake and tolerance in Populus × canescens
C2012-017,徐进,中科院遗传与发育生物学研究所农业资源研究中心,New Phytologist,根,Cd2+
Comparative physiological responses of Solanum nigrum and Solanum torvum to cadmium stress
C2012-016,徐进,中科院遗传与发育生物学研究所农业资源研究中心,New Phytologist,根,Cd2+
Comparative transcriptome analysis of cadmium responses in Solanum nigrum and Solanum torvum
C2012-009,赵福庚,南京大学,PLANT CELL ENVIRON ,根,K+/Ca2+
Cadmium impairs ion homeostasis by altering K+ and Ca2+ channel activities in rice root hair cells
三、常测哪些指标
Cd2+、Pb2+、Cu2+、Ca2+、H+
四、检测这些离子流、分子流,有什么生物学意义
-
2)科研案例
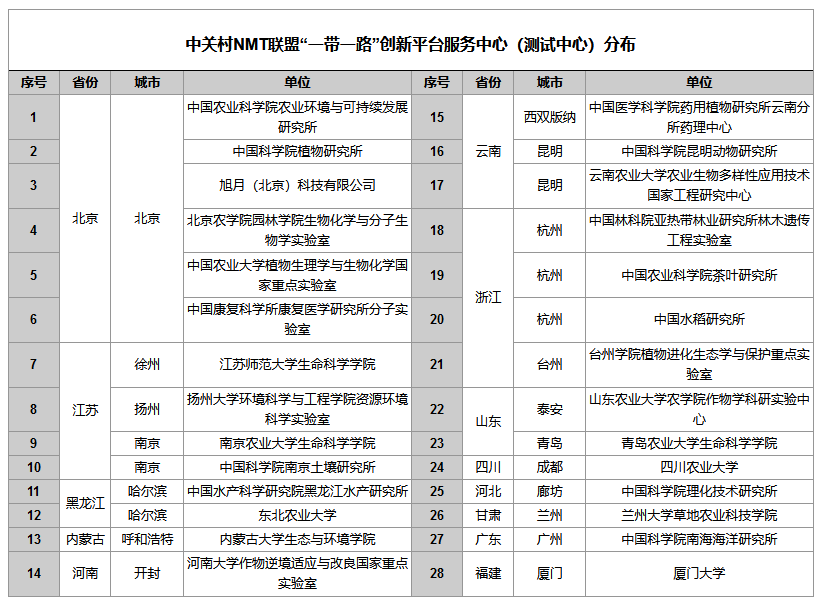
检测拟南芥距根尖Cd2+吸收速率,发现经CdCl2处理后,mpc1-1(AtMPC1 缺 失)根部Cd2+吸收速率明显高于野生型和其他突变型。由此得出:AtMPC1可以抑制植物中Cd2+的积累。AtMPC1缺失时,Cd2+由于吸收增多或者减少外排从而积累。
He L, Jing Y, Shen J, et al. Mitochondrial Pyruvate Carriers Prevent Cadmium Toxicity by Sustaining the TCA Cycle and Glutathione Synthesis. Plant Physiol. 2019;180(1):198-211.
-
2)科研案例
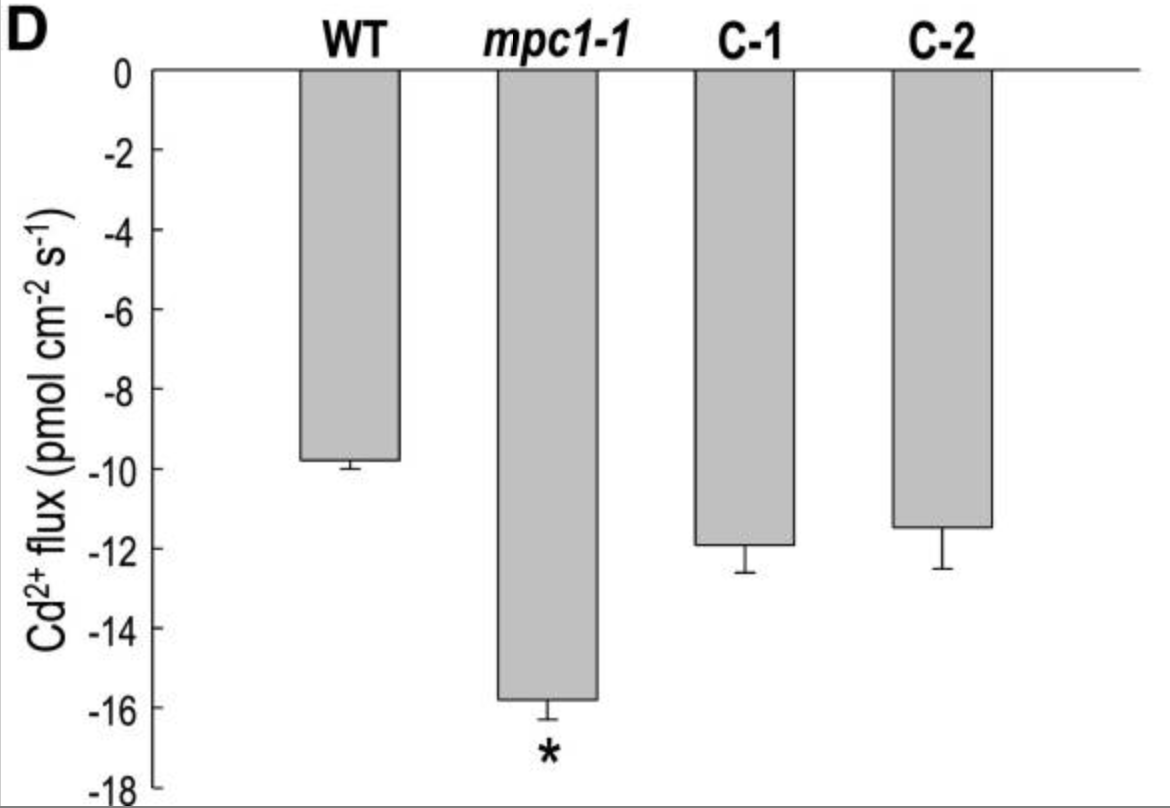
以三种常见湿地植物为材料,芦苇在距根尖大约0-200μm处为Cu2+释放区域,而在0-500μm处表现出Pb2+和Cd2+净外排。尽管在芦苇根部的较老部分中有Cu2+,Pb2+和Cd2+的内流,但总流入量比香蒲或印度香豆小得多。穿过根细胞质膜的这种减少的金属离子吸收和/或增加的金属离子外流,可能在一定程度上解释了芦苇对金属的更高抗性。
Li, L., Yu, S., Peijnenburg, W.J.G.M. et al. Determining the fluxes of ions (Pb2+, Cu2+ and Cd2+) at the root surface of wetland plants using the scanning ion-selective electrode technique. Plant Soil 414, 1–12 (2017).
-
1)H⁺生理功能概述
2)科研案例
利用扫描离子选择性电极技术对Cd胁迫驯化莱茵衣藻进行研究,发现CC-124型与CC-400型莱茵衣藻表面的H+流不明显,长期Cd胁迫驯化培养衣藻也未见有明显流速,加入高浓度Cd 后也未有明显流速产生,结合Cd2+与 Ca2+通量检测,说明其细胞表面 Cd2+与Ca2+、H+的置换反应并不强烈。
霍翔远,季宏兵,朱毅.Cd胁迫对受驯莱茵衣藻影响的非损伤微测初步研究[J].现代农业科技,2010(12):235-237+240.
-
2)科研案例
Ca2+振荡激活损伤基因;抵御胁迫;避免出现免疫反应;与NH4+、H+、Na+等拮抗;低Ca引起植物生理病害;活化酶反应;信号传导。
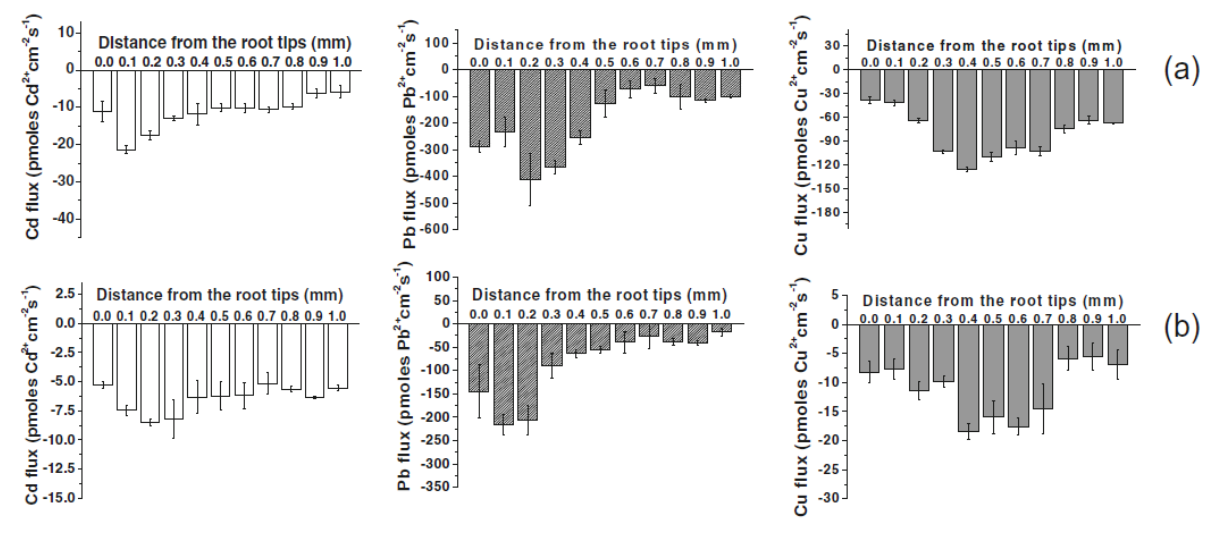
例:以 Paxillus involutus 的 2 种菌株 MAJ 和 NAU 为研究材料,利用 CdCl2对材料进行处理。结果显示,Cd2+处理后,MAJ 和 NAU 菌丝的Cd2+内流增强,同 时也显著促进了Ca2+的内流。Ca2+通道抑制剂处理和H2O2处理后离子通量的结果,说明Paxillus involutus对 Cd2+具有富集作用并且可以通过 H2O2激活 CaPCs 促进Cd2+内流。
朱智梅,张玉红,撒刚,刘建,马旭君,邓晨,赵瑞,陈少良.外生菌根真菌Paxillus involutus吸收Cd2+及H2O2对Cd2+内流的调控作用.北京林业大学学报,2018,40(04):24-32.
五、可以检测哪些样品
1、动物样品
1)细胞
神经细胞、肿瘤细胞、巨噬细胞、淋巴细胞等
2)组织器官
肿瘤、皮肤、胃粘膜、胰岛、脑(海马体等)、胚胎(大鼠、鱼)、斑马鱼皮肤/鳃、耳蜗、心脏(香螺)、卵(鱼、鸡蛋、爪蟾)、骨骼、角膜、脊椎(豚鼠)、肌肉组织(肌纤维、心肌)
3)其它动物样品
珊瑚、螨虫、昆虫(果蝇幼虫的肠、蟑螂血脑屏障、按蚊、长红锥蝽)、蝌蚪、水蛭、蓝蟹(微感毛)、变形虫、水丝蚓
2、植物样品
1)营养器官
茎:边材、心材、微管形成层、木质部
2)生殖器官
花:花瓣、花瓣表皮细胞、花粉
种子:整体、胚
果实:果壳、果皮、果肉(苹果、柑橘)、籽粒、棉花纤维、棉桃
3)细胞:植物悬浮细胞、液泡
4)愈伤组织
3、微生物样品
酵母细胞、菌丝、菌落、微藻、细菌(大肠杆菌)
4、其它生物样品
周丛生物
5、非生物样品
金属、混凝土、泥沙、纳米材料、生物医药材料
六、样品需要做哪些前处理
国际领先的非损伤微测技术最大的特点就是活体、无损检测,因此动植物材料在检测前,不需要任何的液氮速冻、染色、研磨处理等。
1、动物单细胞
因NMT是活体检测,故从培养箱中拿出来后,置于培养皿中,直接检测即可。
2、动物组织
因NMT是活体检测,无需提前处理。如检测部位天然暴露在外,如斑马鱼皮肤离子细胞、侧线毛细胞,直接检测即可。如检测部位位于体内,需在检测时暴露出检测部位(可采用麻醉的方式),后检测即可。
3、植物根茎叶等组织器官
天然暴露在外的组织器官,例如根、茎、叶的表面,无需任何处理,直接检测即可。水培、土培、砂培、平板培养均可。
4、植物原生质体/液泡
因NMT是基于微传感器/探针的非损伤检测,检测时不接触样品,故原生质体、液泡需要从组织或者细胞中,提取出来后检测。
5、植物叶片的表皮细胞、叶肉细胞、盐腺细胞、保卫细胞
无需提前处理。因这些细胞处于组织内部,故检测时采用撕取等方式,暴露出相应细胞即可。
6、植物花粉管
离体萌发:在培养皿中萌发一段时间后即可直接检测;在体萌发:将柱头置于培养皿中,待萌发一段时间后即可直接检测。
7、植物果实
无需提前处理。如待测部位位于果实内部,需在检测前暴露出相应部位即可。
8、植物悬浮细胞
无需提前处理。检测时,置于培养皿中检测即可。
七、有哪些检测方式?
即瞬时处理,是指在检测过程中,在正常测试液中瞬间加入所需的干旱胁迫溶液(PEG或甘露醇等溶液)的处理方法,目的是为了观察瞬间干旱胁迫下,样品短时间内的离子/分子的变化趋势,即短时效应。
2、预处理/提前处理好后检测
是指在干旱胁迫一段较长的时间后(数十分钟/数小时/数天),观察植物离子/分子进出的情况,即长时效应。
八、检测环境是空气还是溶液
检测时,只要求待测部位浸于溶液中(无需整体都浸在溶液里)。
九、样品是如何检测的
十、可以送样检测吗
可以送样检测。目前非损伤微测技术测试服务由中关村NMT产业联盟统筹管理,由遍布全国的25家NMT创新平台服务中心,提供检测服务。点击获取测试服务