干旱胁迫研究NMT标准化方案
干旱胁迫研究NMT标准化方案
一、视频资源
二、参考文献
三、常测哪些指标
K+、Ca2+、H+、Cl-、NO3-、NH4+、IAA、H2O2
四、检测这些离子流、分子流,有什么生物学意义
-
1)K+生理功能概述
2)科研案例
a.案例1
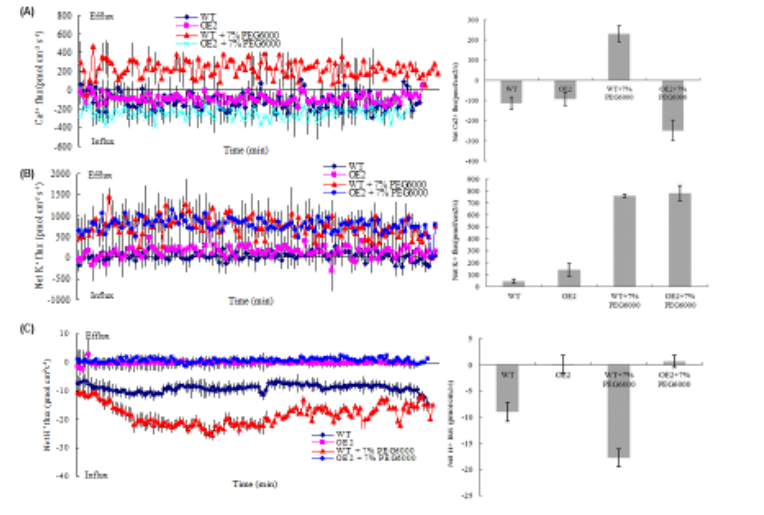
PEG胁迫激活了转基因黄檗的保卫细胞K+外排,Ca2+和H+内流,结合荧光探针和分子实验,共同帮助作者加深对LEA基因功能的理解,并有助于工程化抗旱树种。
Yang J et al. Overexpression of TaLEA3 induces rapid stomatal closure under drought stress in Phellodendron amurense Rupr. Plant Sci. 2018;277:100-109.
b.案例2
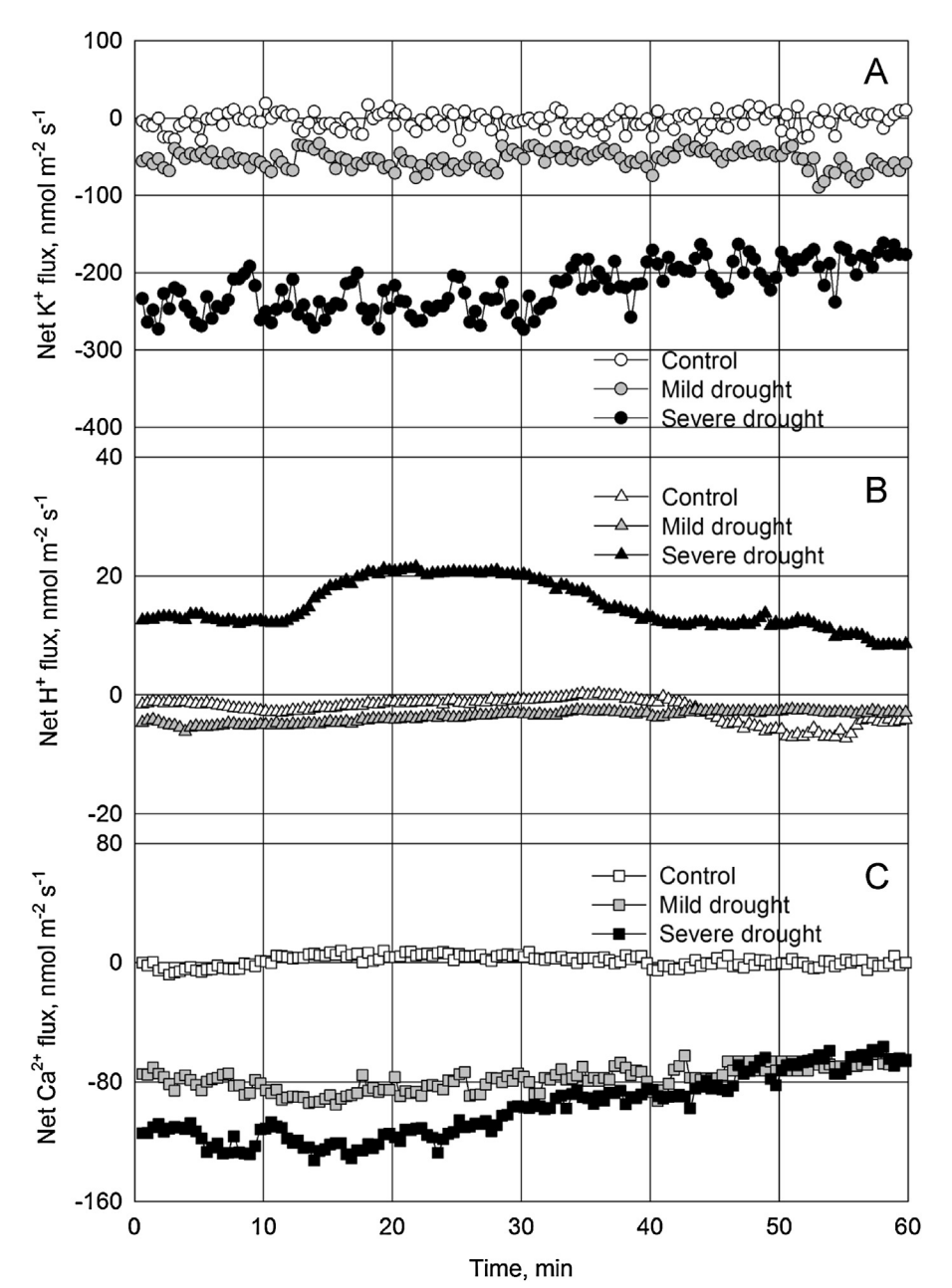
在干旱胁迫下,大豆叶肉的H+内流和K+和Ca2+外排与许多生理特性都高度相关,结合气孔特性、植物生长量等实验结果,说明这些离子的变化可能是大豆干旱胁迫程度的化学信号和重要指标。
Mak, Michelle el al. Leaf mesophyll K+, H+ and Ca2+ fluxes are involved in drought-induced decrease in photosynthesis and stomatal closure in soybean. Environmental and Experimental Botany. 2014, 98, 1-12.
-
2)科研案例
a.案例1
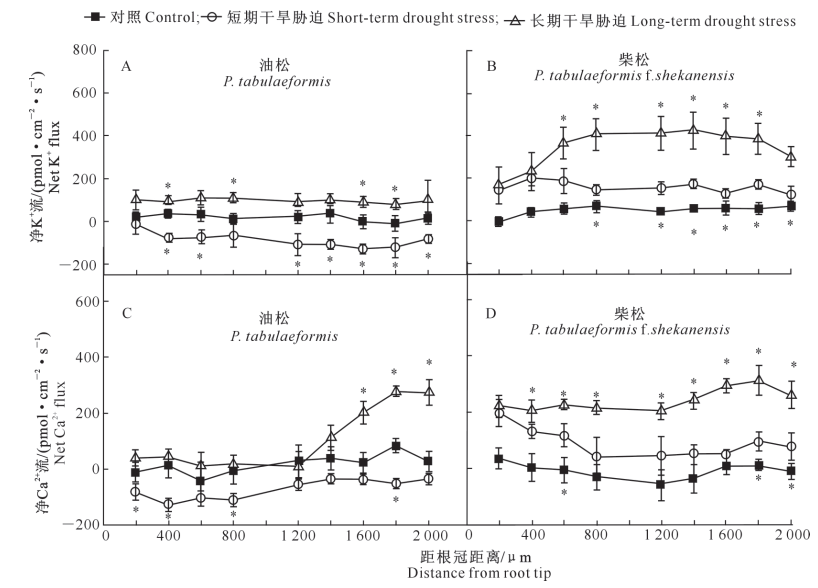
短期胁迫下油松Ca2+内流加强,长期胁迫下在根尖伸长区Ca2+外排加强;柴松在短期与长期干旱胁迫下较对照不同程度地加强了Ca2+外排。结合TAE、Eosin-Y等处理下的油松和柴松K+和Ca2+流速实验结果说明,油松通过较高的H+-ATP酶活性调控依赖 去 极 化 激 活 的 离 子 通 道 限 制K+外流,同时通过Ca2+-ATP酶与Ca2+ 通道调控细胞Ca2+跨膜转运,在组织与根尖表皮细胞上减少K+流失并维持Ca2+平衡,因而较柴松抗旱性强。
王树源, 王富, 唐佳琪,等. 干旱胁迫对油松和柴松钾钙离子流的影响. 西北农林科技大学学报(自然科学版), 2018. doi:10.13207/j.cnki.jnwafu.2018.01.004
b.案例2
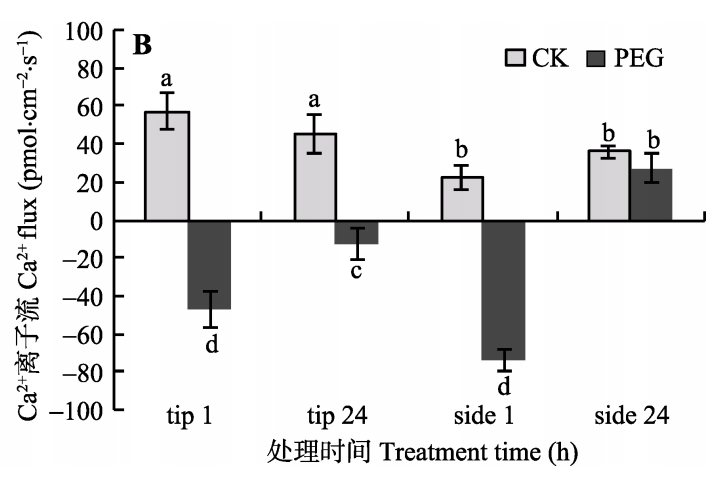
PEG处理1 h后丛枝菌根真菌根(AMF)外菌丝尖端和侧面发生H+外流和强烈的Ca2+内流,结合荧光光谱和场发射扫描电子显微镜实验结果,共同表明, 干旱胁迫下AMF根外菌丝跨膜H+和Ca2+流发生变化, 促进了菌丝与环境之间的物质交换。菌丝酸化生长环境有利于养分吸收, 并促进AMF与宿主植物之间的信号交流以增强植物的耐旱性。
徐丽娇, 郝志鹏, 谢伟,等. 丛枝菌根真菌根外菌丝跨膜H+和Ca2+流对干旱胁迫的响应. 植物生态学报, 2018, 42(07):66-75.
-
1)H+生理功能概述
2)科研案例
a.案例1
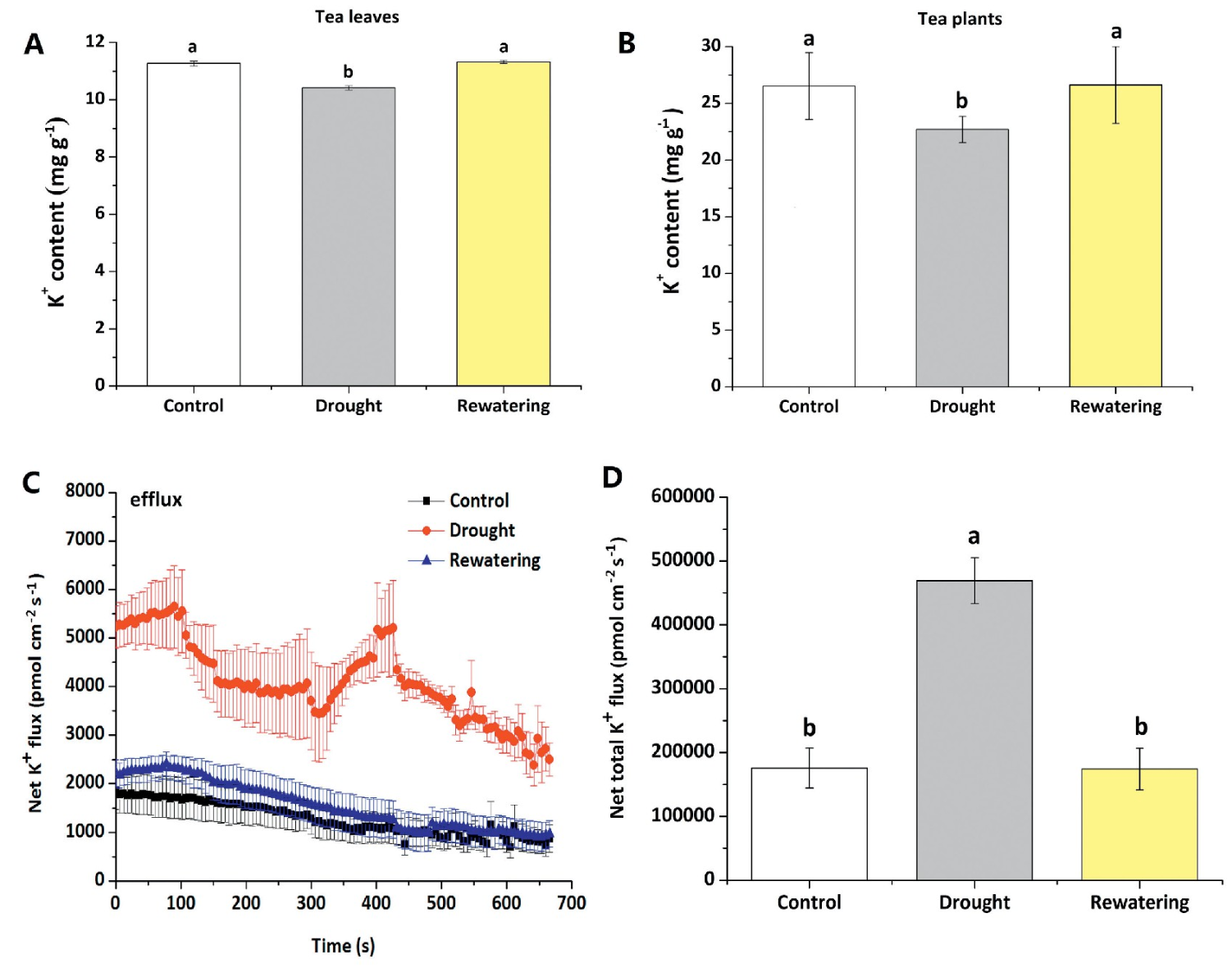
干旱胁迫诱导了H+内流,导致茶树叶肉细胞膜电位去极化并诱导大量K+外排。随后复水诱导了H+外排,导致膜电位超极化,从而降低K+的外排。说明,干旱和复水下茶树的叶肉中K+的维持与质膜H+-ATPase活性的调节有关。
Zhang XZ et al.Maintenance of mesophyll potassium and regulation of plasma membrane H~+-ATPase are associated with physiological responses of tea plants to drought and subsequent rehydration.The Crop Journal,2018,6(06):611-620.
b.案例2
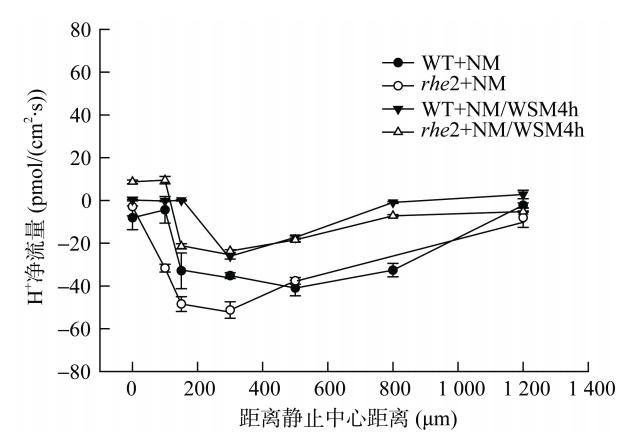
进行短期水分胁迫处理下,野生型拟南芥与rhe2突变体距离静止中心 0~150 μm 的 H+离子流由正常条件下的吸收转变为外排,其他部位H+离子流流速减小,吸收的趋势不变,总体上能够保持正常条件下的 H+离子流平衡,距离静止中心 300~500 μm(过渡区)的 H+离子流吸收趋势不变,吸收速率随时间逐渐减小,这可能与植物在干旱环境下通过分泌大量分泌物来维持细胞伸长过程有密切关系。
李佳, 黄梦静, 任艳,等. 水分胁迫对向水性突变体rhe2根生长与响应的影响.土壤, 2015, 047(005):858-862.

-
2)科研案例
诱导植物产生系统获得抗性、高度敏感抗性和热抗性;引起细胞衰老,诱导程序性死亡;参与ABA调控的气孔关闭;参与根的向地性、生长和不定根形成;细胞壁发育的信号分子;参与柱头和花粉粒的发育与相互作用;参与信号转导;调控基因表达。
例1:高温和干旱胁迫下,非损伤微测技术监测到发芽种子胚芽鞘的H2O2外排,结合ROS、丙二醛含量检测,及抗氧化酶活性分析,表明高温和干旱条件下ABA和ROS的积累,可以抑制水稻种子的萌发和生长。
Liu J et al. High temperature and drought stress cause abscisic acid and reactive oxygen species accumulation and suppress seed germination growth in rice. Protoplasma. 2019;256(5):1217-1227.

-
2)科研案例
a.案例1
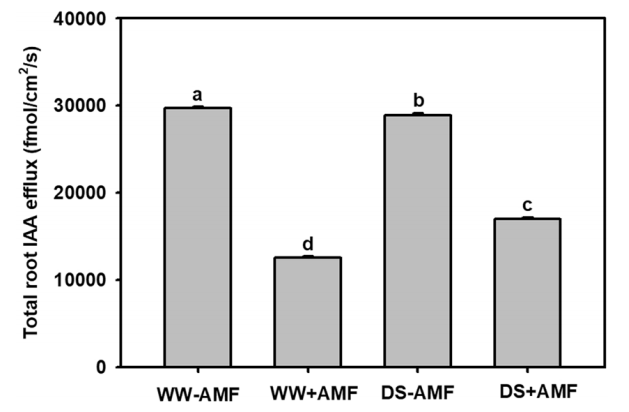
与没有接种AMF的植物相比,在正常水分条件下和干旱胁迫条件下,接种AMF的植物根部IAA外排降低58%和41%。结合其他生理实验和分子实验结果,共同说明AMF可以促进枳的根毛生长和IAA的合成和运输,有利于提高寄主植物的抗旱性。
(Liu CY, Zhang F, Zhang DJ, et al. Mycorrhiza stimulates root-hair growth and IAA synthesis and transport in trifoliate orange under drought stress. Sci Rep. 2018;8(1):1978. Published 2018 Jan 31. doi:10.1038/s41598-018-20456-4)
b.案例2
在干旱条件下,枳的菌根幼苗的叶和根中H2O2、O2和MDA浓度显着低于非菌根幼苗。与非菌根幼苗相比,菌根幼苗在主根和侧根中的根净H2O2外排量相对较高,尤其是在正常水分条件下;而在正常水分和干旱下,主根和侧根中的总H2O2外排量显着较高。根总H2O2外排量与根部定殖显着正相关,而与MDA浓度呈负相关。这表明菌根诱导了主根和侧根的H2O2外排量增加,从而减轻了宿主植物中干旱引起的氧化损伤。
Huang YM et al. Alleviation of drought stress by mycorrhizas is related to increased root H2O2 efflux in trifoliate orange. Sci Rep. 2017;7:42335.
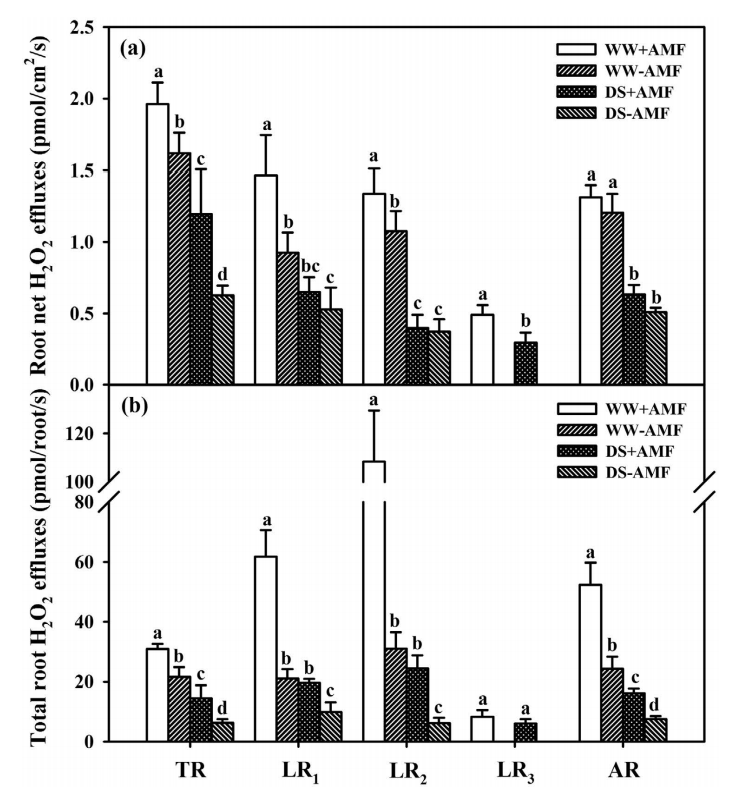
-
2)科研案例
内源H2S诱导拟南芥及lcd的突变体的K+外排,Ca2+和Cl-内流,但不影响H+的跨膜移动。干旱胁迫下,在H2S对气孔运动的调节过程中,K+通道是主要的渗透调节应答器。因此,H2S介导离子通量,诱导拟南芥气孔关闭响应干旱胁迫。
Jin Z et al. Hydrogen sulfide mediates ion fluxes inducing stomatal closure in response to drought stress in Arabidopsis thaliana. Plant & Soil, 2017. doi:10.1007/s11104-017-3335-5
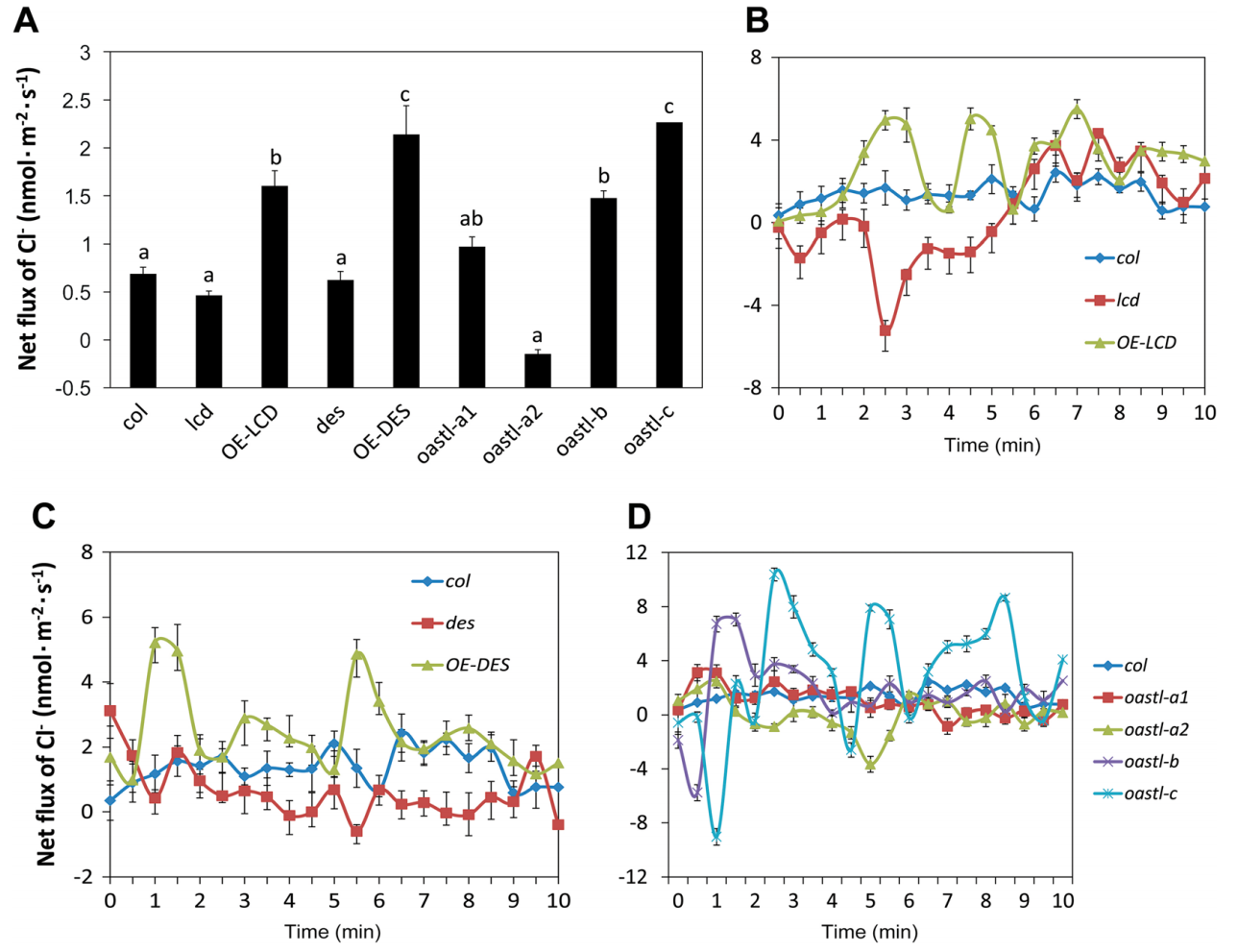
-
2)科研案例
在正常情况下,红柳根部的白色区域(white zone)没有明显的NO3-内流,但是干旱胁迫下,NO3-内流显著增加,N保存能力增强,为土壤干旱和缺N耦合条件下的造林实践和红柳育种提供指导。
Zhang L et al. Characterization and comparison of nitrate fluxes in Tamarix ramosissima and cotton roots under simulated drought conditions. Tree Physiol. 2019;39(4):628-640.
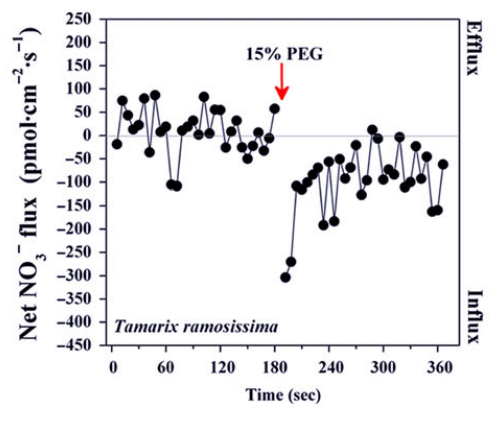
-
2)科研案例
实验发现增加外源N可以缓解干旱胁迫对植物生长带来的负面影响,而干旱胁迫下海棠果的NO3-内流降低,NH4+内流显著增加,说明NH4+在改善海棠果耐旱能力方面发挥了更重要的作用。
Huang L et al. Uptake and metabolism of ammonium and nitrate in response to drought stress in Malus prunifolia. Plant Physiol Biochem. 2018;127:185-193.
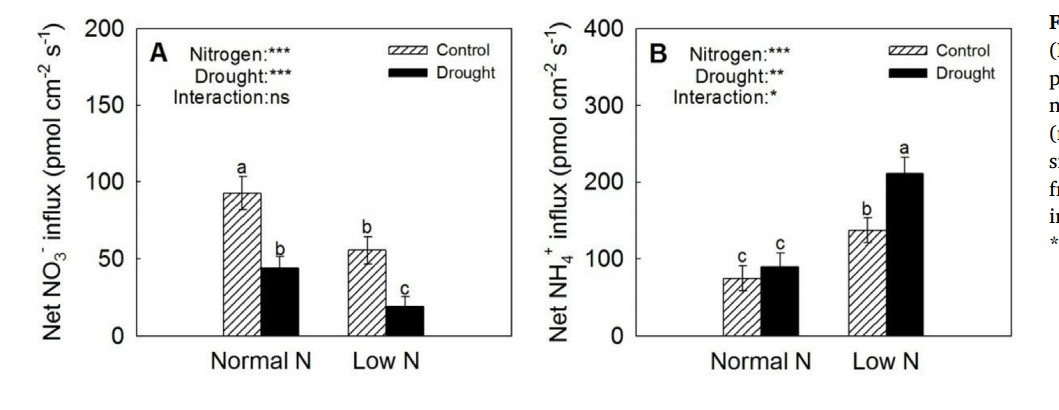
参见《植物营养研究NMT解决方)NO3-生理功能概述
五、可以检测哪些样品
1、动物样品
1)细胞
神经细胞、肿瘤细胞、巨噬细胞、淋巴细胞等
2)组织器官
肿瘤、皮肤、胃粘膜、胰岛、脑(海马体等)、胚胎(大鼠、鱼)、斑马鱼皮肤/鳃、耳蜗、心脏(香螺)、卵(鱼、鸡蛋、爪蟾)、骨骼、角膜、脊椎(豚鼠)、肌肉组织(肌纤维、心肌)
3)其它动物样品
珊瑚、螨虫、昆虫(果蝇幼虫的肠、蟑螂血脑屏障、按蚊、长红锥蝽)、蝌蚪、水蛭、蓝蟹(微感毛)、变形虫、水丝蚓
2、植物样品
1)营养器官
茎:边材、心材、微管形成层、木质部
2)生殖器官
花:花瓣、花瓣表皮细胞、花粉
种子:整体、胚
果实:果壳、果皮、果肉(苹果、柑橘)、籽粒、棉花纤维、棉桃
3)细胞:植物悬浮细胞、液泡
4)愈伤组织
3、微生物样品
酵母细胞、菌丝、菌落、微藻、细菌(大肠杆菌)
4、其它生物样品
周丛生物
5、非生物样品
金属、混凝土、泥沙、纳米材料、生物医药材料
六、样品需要做哪些前处理
国际领先的非损伤微测技术最大的特点就是活体、无损检测,因此动植物材料在检测前,不需要任何的液氮速冻、染色、研磨处理等。
1、动物单细胞
因NMT是活体检测,故从培养箱中拿出来后,置于培养皿中,直接检测即可。
2、动物组织
因NMT是活体检测,无需提前处理。如检测部位天然暴露在外,如斑马鱼皮肤离子细胞、侧线毛细胞,直接检测即可。如检测部位位于体内,需在检测时暴露出检测部位(可采用麻醉的方式),后检测即可。
3、植物根茎叶等组织器官
天然暴露在外的组织器官,例如根、茎、叶的表面,无需任何处理,直接检测即可。水培、土培、砂培、平板培养均可。
4、植物原生质体/液泡
因NMT是基于微传感器/探针的非损伤检测,检测时不接触样品,故原生质体、液泡需要从组织或者细胞中,提取出来后检测。
5、植物叶片的表皮细胞、叶肉细胞、盐腺细胞、保卫细胞
无需提前处理。因这些细胞处于组织内部,故检测时采用撕取等方式,暴露出相应细胞即可。
6、植物花粉管
离体萌发:在培养皿中萌发一段时间后即可直接检测;在体萌发:将柱头置于培养皿中,待萌发一段时间后即可直接检测。
7、植物果实
无需提前处理。如待测部位位于果实内部,需在检测前暴露出相应部位即可。
8、植物悬浮细胞
无需提前处理。检测时,置于培养皿中检测即可。
七、有哪些检测方式?
即瞬时处理,是指在检测过程中,在正常测试液中瞬间加入所需的干旱胁迫溶液(PEG或甘露醇等溶液)的处理方法,目的是为了观察瞬间干旱胁迫下,样品短时间内的离子/分子的变化趋势,即短时效应。
2、预处理/提前处理好后检测
是指在干旱胁迫一段较长的时间后(数十分钟/数小时/数天),观察植物离子/分子进出的情况,即长时效应。
八、检测环境是空气还是溶液
检测时,只要求待测部位浸于溶液中(无需整体都浸在溶液里)。
九、样品是如何检测的
十、可以送样检测吗
可以送样检测。目前非损伤微测技术测试服务由中关村NMT产业联盟统筹管理,由遍布全国的25家NMT创新平台服务中心,提供检测服务。点击获取测试服务